動物実験に心を痛めていても、「具体的に何をしたらいいのか分からない」と感じている方は少なくありません(*1)。本稿では、医薬品・化学物質の安全性試験を中心に、教育や農業など他の分野も含めて、動物の苦しみを減らすためにできる「3Rs推進とNAMs開発を後押しする声の届け方」をお伝えします(*2)。
いま日本で行われている動物実験
私たちが日常的に使っている医薬品や化粧品、洗剤、農薬などの安全性を確かめるために、多くの動物が実験に使われてきました(*3)。日本では、実験に使われる「頭数」を行政が一元的に公表していませんが、実験用マウスやラットなどの販売数を手がかりにすると、年間で数百万匹規模の動物が実験に利用されていると推計されています(*4)。
大学や研究所では、病気の仕組みを調べる基礎研究のほか、学生の教育・実習でも動物が使われてきました(*5)。また、農業や水産の分野でも、家畜や魚を対象にした試験研究が行われています(*6)。こうした研究には人の健康や食料生産に役立つ面がある一方で、「動物の苦痛をできるだけ減らしてほしい」という願いも、多くの市民が共有しているのではないでしょうか(*2)。
3RsとNAMsって何?
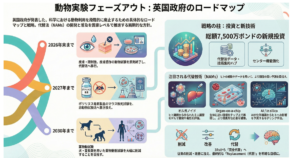
動物実験の世界には、「3Rs」と呼ばれる国際的な原則があります(*7)。
3Rsとは、次の3つの英単語の頭文字をとった言葉です(*7)。
- Replacement(リプレイスメント):動物を使わない方法に置き換えること
- Reduction(リダクション):使う動物の数を減らすこと
- Refinement(リファインメント):やむをえず動物を使う場合でも、苦痛やストレスを和らげること
日本でも、環境省や文部科学省などが出している動物実験の指針の中で、この3Rsが大切な考え方として書かれています(*8)(*9)。法律(動物愛護管理法)にも、科学上の利用において動物の苦痛を避けることや減らすことが明記されており、「苦痛の軽減」は義務として位置づけられています(*10)。
もう一つ、最近よく使われるようになってきたのが「NAMs(ナムス)」という言葉です(*11)。NAMsは「New Approach Methodologies」の略で、細胞や組織を使った試験、ヒトの皮膚モデル、コンピュータによる予測モデルなど、できるだけ動物に頼らずに安全性を評価しようとする新しい方法の総称です(*11)。
たとえば、皮膚のアレルギー(感作性)を調べる試験では、ヒトの皮膚細胞を用いた方法や、複数の試験を組み合わせた「定義されたアプローチ(Defined Approaches)」が、OECDテストガイドライン(例:TG 497)として採用され、日本でも実用化が進んでいます。(*12)。
日本のルールとその「限界」
日本では、動物愛護管理法や関連省庁の指針によって、動物実験に一定のルールが定められています(*8)(*10)。研究機関の多くは、動物実験委員会を設けて、実験計画が妥当かどうか、苦痛を減らす工夫がされているかどうかを事前に審査しています(*9)(*13)。これは、何のルールもなく動物が使われていた時代から比べれば、大きな前進と言えます。
しかし、その一方で、法律の条文や指針をよく見ると、「できる限り」「配慮するものとする」という表現が多く使われており、とくに3Rsのうち「Replacement(代替)」と「Reduction(削減)」は、まだ強い義務としては位置づけられていない面があります(*10)(*14)。代替法やNAMsが存在しても、それを必ず使わなければならないとは限らない、という読み方もできてしまうのが現状です(*14)。
また、動物実験委員会の審査や、その結果の公表のしかたも、研究機関によってばらつきがあります(*13)。ウェブサイトで詳細を公開している機関もあれば、概要のみ、あるいはほとんど情報が得られないところもあります(*13)。市民の側から見ると、「本当に3Rsが十分に検討されているのか」が分かりにくいと感じるのは当然かもしれません。
医薬品・化学物質の安全性試験でできること
医薬品や化学物質の安全性試験の世界では、すでに国際的にさまざまなNAMsが開発され、OECDのテストガイドラインとして認められてきています(*12)(*15)。日本国内でも、厚生労働省や環境省の研究事業を通じて、ヒトiPS細胞を用いた毒性評価や、コンピュータによる毒性予測モデルの開発など、具体的なNAMsの導入が進められています。(*15)。
たとえば、皮膚感作性(アレルギーを起こす性質)については、動物を使う従来の試験の代わりに、いくつかのNAMsを組み合わせることで、動物の使用数を大きく減らせる可能性が示されています(*12)(*15)。また、毒性のメカニズム(どのようなステップを踏んで細胞が傷つくのか)に注目する「毒性経路(AOP)」という考え方も広がりつつあり、これもNAMsを活用するための重要な土台になっています(*11)(*15)。
ただし、どんな化学物質にもNAMsだけで完全に対応できるわけではなく、長期的な影響や全身に及ぶ影響については、まだ課題も残っています(*15)。だからこそ、「いきなり動物実験をすべてなくす」のではなく、「科学的に妥当な範囲で、まず置き換えられるところから確実に置き換え、使う動物の数を減らしていく」ことが現実的で、重要なのだと思います(*11)(*14)。
他の分野(教育・基礎研究・農業)でも
医薬品や化学物質以外の分野でも、3RsとNAMsの考え方は同じように大切です(*7)。
- 教育・実習の分野では、コンピュータシミュレーションやモデル教材を使った授業、動画教材などによって、動物を使う機会を減らす取り組みが始まっています(*16)。
- 大学などの基礎研究では、「本当に動物が必要な研究かどうか」を検討すること、苦痛の少ない麻酔や鎮痛を徹底すること、同じような実験を何度も繰り返さないことなどが、3Rsの実践につながります(*8)(*13)。
- 農業や水産の分野でも、飼養環境の工夫や、試験の設計方法を見直すことで、動物の苦痛を減らしたり、必要な個体数を抑えたりする工夫が考えられています(*6)(*14)。
どの分野でも、「科学の発展」と「動物福祉」を対立させるのではなく、両方を大事にする方向に舵を切ることが、大きなテーマになっています(*2)(*7)。
あなたの一通の声ができること
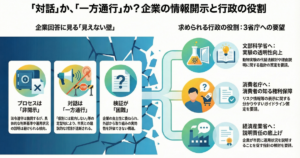
「法律や指針を変えるなんて、自分には遠い話のように感じる」と思われるかもしれません。けれども、日本の省庁は多くの場合、パブリックコメント(意見募集)や問い合わせフォームを通じて、市民からの意見を受け付けています(*17)。そうした意見は、すぐに劇的な変化を生まなくても、見直しのたびに参考資料として蓄積され、担当者や審議会の議論に影響を与えていきます。実際に、過去のパブリックコメントがきっかけとなって、動物実験に関する指針の見直しが行われた事例もあります。(*17)。
とくに、文部科学省、環境省、農林水産省など、動物実験を行う施設や分野を所管している省庁に対して、「3RsとNAMsをもっと進めてほしい」という声を丁寧に届けることは、現場の研究者や担当者にとっても大切な後押しになります(*9)(*15)。「社会もこの方向性を望んでいるのだ」と感じてもらえることが、政策を進める大きな支えになるからです(*2)。
そのまま使える意見・メール文の例
ここからは、実際に意見募集フォームやメールで使える、汎用的なテンプレートをご紹介します。宛先の省庁名や担当部署名を入れ替えて、あなたの言葉を少し足していただくだけでも十分です。
汎用テンプレート(1)
(件名例)3Rsと代替法の一層の推進に関するお願い
○○省 ○○ご担当者様
私は、日頃から医薬品や日用品の安全性を支えてくださっている研究・行政の皆様に感謝しながら、同時に、そこで使われる動物たちのことも気になっている一市民です。
御省の動物実験に関する指針や取り組みを拝見し、3Rsの考え方が取り入れられていることを知りました。今後さらに、代替法やNAMsの開発・導入が進み、動物の苦痛と使用数が着実に減っていくことを願っております。
そのために、可能であれば、
・代替法・NAMsに関する情報発信をわかりやすく行っていただくこと
・市民からの意見や質問に対する窓口を今後も維持・充実させていただくこと
・国として3RsやNAMsを推進する方針を、より明確に示していただくこと
をお願いしたいと考えております。微力ではありますが、私自身も情報を学び、周囲に伝えていきたいと思っております。どうか今後とも、動物福祉と科学の両立を目指す政策を進めていただけましたら幸いです。
汎用テンプレート(2)
(件名例)イヌ・サル使用試験での3Rs推進に関するご要望
○○省 ○○ご担当者様
日頃より、医薬品の安全性確保と規制行政にご尽力されていることに、心より敬意を表します。
私は、医薬品の非臨床安全性評価において、現在もイヌ(安全性薬理試験、反復投与毒性試験など)やサル(特にバイオ医薬品評価)といった非げっ歯類動物が用いられている現状について、3Rsの観点から関心を寄せています。
近年、日米欧で共通に採用されている ICH M3(R2) により、単回投与毒性試験を含む非臨床試験の設計は、目的や既存データに応じて動物使用を最小化する方向へと整理・調和が進められてきました。特に欧州では、3Rsの原則に基づき、必要最小限の動物数で最大限の情報を得ることが明確な方針として示されています。
こうした国際的な枠組みをさらに活かし、非げっ歯類を用いる試験においても、NAMsをより積極的に活用できる余地があるのではないかと考えております。
つきましては、以下の点についてご検討いただけましたら幸いです。
・イヌ・サルを用いる非臨床試験における、NAMsの優先的検討および適用可能範囲の明確化
・ICH調和の考え方を踏まえた、試験設計の柔軟な運用(目的に応じた動物種・試験構成の検討)
・将来的な動物使用削減に向け、開発費の一部をNAMs研究・実装への投資として促進する仕組みの検討動物の苦痛を可能な限り減らしつつ、科学的妥当性と医薬品開発の質を高めていくことは、社会的にも重要な課題であると考えております。
その実現に向け、貴省のお取り組みに期待するとともに、今後のご検討を心よりお願い申し上げます。
これらのテンプレートは、文部科学省、環境省、農林水産省など、どの省庁にも宛てられるようにしてあります。宛先や「医薬品」「農薬」「大学での研究」など、あなたが特に気になっている分野の言葉を足していただくと、より伝わりやすくなると思います(*17)。
一緒に「できる限り」を「当たり前」に
動物実験の問題は、とても大きく、簡単には答えが出ません。それでも、3RsとNAMsという共通の土台があるからこそ、「動物の苦痛を減らしたい」という思いと、「人の健康や安全を守りたい」という願いを、両方とも大切にしていく道筋が見えてきます(*2)(*7)。
あなたが今日送る一通の意見は、すぐに法律を変えるわけではないかもしれません。それでも、「代替法があるところでは、それを使うのが当たり前」という社会をつくるための、小さくて確かな一歩になります(*14)(*15)。もし少しでも「何かしたい」と感じているなら、完璧な文章でなくても大丈夫です。あなたの率直な声が、行政や研究者にとっての大切なメッセージになります。
医薬品開発で使われる動物とお金
医薬品の安全性試験として、ヒトに投与する前の段階で、多数の動物を用いた非臨床試験が大きな役割を担っており、そのためにかなりの研究費が投じられていることが公的資料や専門解説から読み取れます(※18)(※19)。
新薬1品目の開発費は、2020年代初頭のデータでは全体で数百億〜1000億円規模とされており、その一部として、非臨床の毒性試験パッケージに数億〜10億円規模のコストがかかると報告されています。(※19)(※20)。安全性の確保という目的のもととはいえ、その裏側で多くの動物が長期間の試験に使われている現実があります(※21)。
非臨床安全性試験の「パッケージ」と費用
承認申請に必要とされる非臨床安全性試験は、一つの候補薬について「パッケージ」として組み合わされます(※18)(※21)。
代表的なものとして、急性の毒性を見る単回投与毒性試験、一定期間繰り返し投与したときの影響を見る反復投与毒性試験、生殖や胎児への影響を調べる生殖・発生毒性試験、遺伝子レベルの影響をみる遺伝毒性(変異原性)試験、長期的ながん化リスクをみるがん原性試験、心臓・呼吸・中枢神経などの機能に影響がないかを調べる安全性薬理試験などがあります(※18)(※21)。
これらは国際的なガイドライン(ICHガイドラインなど)に沿って設計されます。近年では、たとえばがん原性試験に関するICH S1Bガイドラインが改訂され、発がん性リスクの評価においても、より柔軟で科学的根拠に基づいた設計が可能になっています。(※21)(※22)。
日米EUで異なる「動物の使い方」
非臨床安全性試験の枠組みはICHガイドラインで国際的な調和が進んでいますが、それでもなお、動物の使い方には地域ごとの違いが残っています(※20)(※21)。
たとえば単回投与(急性)毒性試験については、かつては日本と欧米で動物種数や試験設計に違いがあると指摘されてきました。しかし現在では、日米欧で共通に採用されている ICH M3(R2) により、反復投与毒性試験や薬理試験などから急性毒性に関する十分な情報が得られる場合には、単回投与毒性試験を独立して実施することは一般に推奨されていません(*30)。
探索的臨床試験やマイクロドーズ試験など、限定的なヒト曝露を想定した開発段階では、extended single-dose toxicity study が例外的に用いられる場合がありますが、その場合でも通常は1種(多くはげっ歯類)での実施が想定されています(*31)。
欧州(EU)では、単回投与毒性に関する旧来のガイダンスを撤廃したうえで、3Rの原則に基づき、必要最小限の動物数で最大限の情報を得ることを明確な方針として打ち出しています(*32)(*33)。
生殖毒性試験の実施タイミングにも違いがあります。妊娠する可能性のない女性を対象とする開発では三極とも生殖毒性試験を省略できる点は共通ですが、妊娠する可能性のある女性が対象となる場合、日本・アメリカ・EUで「いつまでにどの試験を終えておくか」の基準が異なります(※20)(※21)。
受胎能に関する試験や胚・胎児毒性試験について、日本は第Ⅰ相試験開始前までにデータ取得を求めるなど、比較的早い段階で胎児への影響を確認することを義務付けており、避妊の有無を前提に柔軟な運用を認めるアメリカや、一部項目を第Ⅲ相までに求めるEUとは運用が異なります(※20)。
海外企業から導入した医薬品を日本で開発する際には、こうした非臨床要件の相違により、追加の動物試験が必要になる場合があることも指摘されています(※20)(※21)。
どの動物がどの試験に使われているか
動物種については、ラットやマウスといったげっ歯類に加え、少なくとも1種の非げっ歯類(多くの場合イヌ)が用いられることが標準的な前提になっています(※21)(※22)。
反復投与毒性試験では、ラットなどの哺乳類に数週間から数カ月といった期間、繰り返し投与し、体重変化や血液検査、臓器の病理所見などを詳細に評価します(※23)(※21)。
非げっ歯類側ではイヌが用いられることが多く、ヒトの予定投与期間に見合う、あるいはそれを上回る期間での投与が推奨されるため、同じ候補薬についてラットとイヌの両方で長期の試験が行われることになります(※21)(※24)。
さらに、生殖・発生毒性ではラットやウサギが用いられ、必要に応じてがん原性試験が追加されるなど、一つの医薬品候補に対して多数のラット、マウス、イヌ、ウサギが組み合わせて使われる構造になっています(※18)(※21)(※17)。
イヌが担う役割:単回・反復毒性と安全性薬理
こうした枠組みの中で、イヌやサルが担わされている役割もより具体的に知ることができます。
単回投与毒性試験(急性毒性)では、ラットなどのげっ歯類に加えて、少なくとも1種の非げっ歯類で評価することが推奨され、その代表例がビーグル犬です(※21)(※25)。
イヌには単回で薬剤が投与され、一般状態、血液検査、心電図などが詳しく観察されます(※21)(※25)。
数週間から数カ月、場合によってはそれ以上にわたる反復投与毒性試験でも、げっ歯類(ラットなど)と非げっ歯類(多くはイヌ)の2種の哺乳動物での実施が標準とされ、臨床試験の投与期間と同等かそれを上回る期間で投与が行われます(※21)(※24)。体重や摂餌量、血液・尿検査、剖検による臓器の病理検査などが繰り返し行われ、多数のイヌが使われることになります(※21)。
安全性薬理試験でも、イヌは重要な役割を担っています。ICH S7Aガイドラインは、中枢神経系・心血管系・呼吸器系に対する影響を評価する「コアバッテリー」を規定しており(※26)(※27)、心血管・呼吸機能の評価では、テレメトリー装置を装着したイヌを用いて、覚醒下で心電図、血圧、心拍数、呼吸数などを連続的に測定する試験が広く行われています(※27)(※28)。薬による不整脈や血圧変動のリスクを検出することが目的ですが、そのためにイヌは侵襲的な手術や長期の拘束を受けます(※27)(※25)。
サルが担う役割:バイオ医薬品などの評価
一方、サルは主に、ヒトに特異的に作用するバイオテクノロジー応用医薬品(抗体医薬など)の評価に使われています。
バイオ医薬品では、ラットやイヌでは薬理作用が十分に再現できない場合があり、そのようなケースでは、ヒトの受容体に近いカニクイザルなどの霊長類が、一般毒性試験や反復投与毒性試験に用いられることが専門ガイドラインに示されています(※22)。
特に、薬理作用や毒性の評価に「薬理学的に関連のある種」を用いるべきとされ、その候補として霊長類が挙げられています(※22)(※29)。生殖・発生毒性についても、原則はラットやウサギで実施されますが、げっ歯類モデルが適切でないバイオ医薬品の場合には、サルが妊娠・胎児発育を評価する試験に使われることがあり、繁殖から出産までを含む長期の試験に組み込まれることがあります(※22)(※29)。
NAMsへの投資と3Rの視点から
このように、イヌは単回投与毒性、反復投与毒性、安全性薬理(特に心血管・呼吸)などで非げっ歯類の代表として、サルは主にバイオ医薬品の一般毒性や生殖・発生毒性試験で「ヒトに近い種」として位置づけられています(※21)(※22)(※26)。
これらの試験は患者さんにとっての安全性を担保する上で重要な役割を持つ一方で、動物にとっては長期間にわたる拘束や苦痛、最終的な安楽殺を伴うことがほとんどです(※21)(※25)。
新薬開発全体にかかる莫大な費用の中で、非臨床の毒性試験パッケージにも数億〜10億円規模の予算が継続的に投じられていることを考えると(※19)(※20)、その一部を動物を使わない、あるいは動物使用を大幅に減らす新しいアプローチ(NAMs)の開発・標準化に振り向けてほしい、という問題意識が自然と生まれてきます(※30)(※29)。
実際、国際的なガイドラインや日本の通知でも、3R原則(置換・削減・改善)への配慮や、科学的に妥当な範囲での動物使用削減の必要性が強調されるようになってきました(※22)(※21)。
一部の毒性分野では、細胞を用いた試験系やヒト由来の組織モデル、計算科学による予測などを組み合わせることで、動物数を減らしながら安全性評価を行う取り組みも進んでいます(※30)。
イヌやサルなど高い認知能力をもつ動物を含め、非臨床試験の負担をこれ以上拡大させるのではなく、「必要な安全性情報の多くをNAMsで補い、動物試験はどうしても代替できない部分に限る」という方向に、研究投資と規制の重点を移していくことが求められているのではないでしょうか(※21)(※30)(※29)。
参照リスト
*1 環境省「動物の愛護及び管理に関する法律」解説資料(動物実験関連部分)
https://www.env.go.jp/nature/dobutsu/aigo/2_data/pamph/h2911/3-1.pdf
*2 環境省 中央環境審議会「実験動物の適正な飼養保管等を推進するために」
https://www.env.go.jp/council/content/i_10/900435405.pdf
*3 日本獣医師会雑誌「動物愛護管理法における3R原則の明文化と実験動物の適正」
(Agriknowledge収録PDFへの導入ページ例)
https://agriknowledge.affrc.go.jp/RN/2010792401.pdf
*4 日本実験動物協会の「実験動物総販売数調査」を引用する二次資料(Animals Voice Japan内解説)
https://animals-peace.net/experiments/animals-scienceuse-sales-stat.html
*5 文部科学省「研究機関等における動物実験等の実施に関する基本指針」
https://www.mext.go.jp/b_menu/hakusho/nc/06060904.htm
*6 国際農林水産業研究センター「動物実験基本指針」
https://www.jircas.go.jp/ja/law/experimentonanimals
*7 藤田医科大学 CAMHD「3Rの原則について」
http://www.fujita-hu.ac.jp/~camhd/CAMHD/experiment-insidecampus/tendercare2020/3R.html
*8 環境省「実験動物の飼養及び保管等に関する基準」関連資料(解説)
https://www.env.go.jp/nature/dobutsu/aigo/2_data/pamph/h2911/3-1.pdf
*9 国立研究開発法人 国立環境研究所「動物実験委員会|研究倫理」
https://www.nies.go.jp/kenkyurinri/rinri-doubutsu/index.html
*10 環境省「動物の愛護及び管理に関する法律」第41条 解説(パンフレット内該当箇所)
https://www.env.go.jp/nature/dobutsu/aigo/2_data/pamph/h2911/3-1.pdf
*11 厚生労働科学研究「国内外で開発されOECDで公定化されるNAMを活用した試験…」プロジェクトページ
https://mhlw-grants.niph.go.jp/project/177816
*12 皮膚感作性試験「EpiSensA」受託開始の案内(日本コルマー関連サイト例)
https://jc-dermalabo.jp/news/news-1145/
*13 国立環境研究所「動物実験委員会|研究倫理」(委員会の役割説明部分)
https://www.nies.go.jp/kenkyurinri/rinri-doubutsu/index.html
*14 「動物愛護管理法における3R原則の明文化と実験動物の適正」に関する解説論文
https://jvma-vet.jp/mag/06306/a2.pdf
*15 厚生労働科学研究「国内外で開発されOECDで公定化されるNAMを活用した試験…」総括報告書PDF
https://mhlw-grants.niph.go.jp/system/files/report_pdf/202425004A-sokatsu.pdf
*16 教育・研究における動物の取り扱いに関する解説(秋田大学医学部例)
http://www.med.akita-u.ac.jp/~doubutu/WELFARE/gakujutudoukou.html
*17 各省庁のパブリックコメント制度・意見募集の案内(環境省の例)
https://www.env.go.jp/info/iken/index.html
*18 医薬品の製造(輸入)承認申請に必要な毒性試験のガイドライン
https://www.mhlw.go.jp/web/t_doc?dataId=00ta7139&dataType=1&pageNo=1
*19 製薬産業の研究開発費に関する解説(日本製薬工業協会資料等の例)
https://www.jpma.or.jp/information/ich/conference/pdf/11_ich131210.pdf
*20 第3章 治療開発のための研究2:非臨床試験(ICR臨床研究入門)
https://www.icrweb.jp/mod/resource/view.php?id=24
*21 医薬品の臨床試験のための非臨床安全性試験の実施時期に関するガイドライン(PMDA)
https://www.pmda.go.jp/files/000156828.pdf
*22 バイオテクノロジー応用医薬品の非臨床における安全性評価(PMDA)
https://www.pmda.go.jp/files/000156471.pdf
*23 哺乳類を用いる28日間の反復投与毒性試験(国立医薬品食品衛生研究所・通知)
http://www.nihs.go.jp/mhlw/chemical/kashin/hourei/tuuti/shiken5.pdf
*24 Guideline on Repeated Dose Toxicity(EMA)
https://www.ema.europa.eu/en/documents/scientific-guideline/draft-guideline-repeated-dose-toxicity_en.pdf
*25 An Approach to Minimise Dog Use in Regulatory Toxicology(RSPCA)
https://science.rspca.org.uk/documents/d/science/anapproachtominimisedoguse
*26 ICH S7A Safety Pharmacology Studies for Human Pharmaceuticals(EMA)
https://www.ema.europa.eu/en/ich-s7a-safety-pharmacology-studies-human-pharmaceuticals-scientific-guideline
*27 S7A Safety Pharmacology Studies for Human Pharmaceuticals(FDA)
https://www.fda.gov/media/72033/download
*28 Safety pharmacology – Core battery of studies – ICH S7A/S7B(受託機関による説明ページの一例)
https://www.vivotecnia.com/safety-pharmacology/
*29 治療用放射性医薬品の非臨床試験と関連ガイドライン(霊長類使用の位置づけを含む例)
https://www.mhlw.go.jp/web/t_doc?dataId=00tc9261&dataType=1&pageNo=1
*30 PMDA(医薬品医療機器総合機構)
ICH M3(R2)「医薬品の臨床試験及び製造販売承認申請のための非臨床安全性試験の実施について」
https://www.pmda.go.jp/files/000156128.pdf
*31 European Medicines Agency (EMA)
ICH M3(R2) guideline(マイクロドーズ試験・探索的試験に関する記述を含む)
https://www.ema.europa.eu/en/documents/scientific-guideline/ich-m-3-r2-non-clinical-safety-studies-conduct-human-clinical-trials-and-marketing-authorization-pharmaceuticals-step-3_en.pdf
*32 European Medicines Agency (EMA)
Questions and answers on the withdrawal of the Note for Guidance on single dose toxicity
https://www.ema.europa.eu/en/documents/scientific-guideline/questions-answers-withdrawal-note-guidance-single-dose-toxicity_en.pdf
*33 European Medicines Agency (EMA)
ICH M3(R2) Questions and Answers(extended single-dose toxicity、動物数、3Rの考え方)
https://www.ema.europa.eu/en/documents/other/international-conference-harmonisation-technical-requirements-registration-pharmaceuticals-human-use-ich-m3-r2-questions-and-answers-step-5_en.pdf